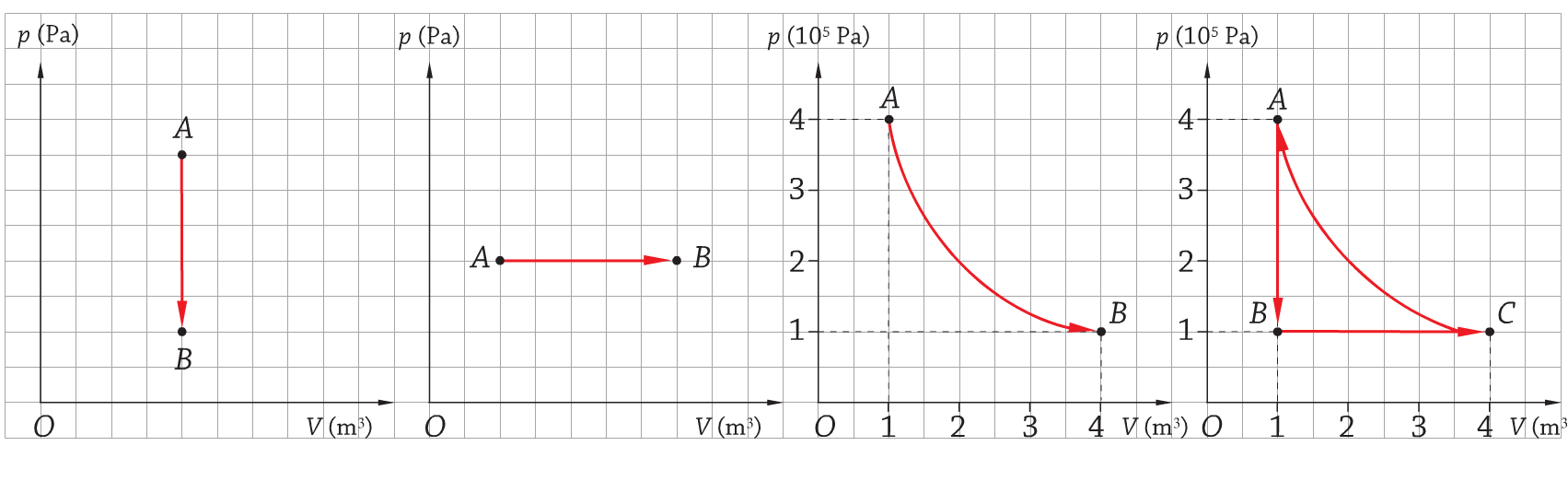
Per rappresentare le trasformazioni termodinamiche viene utilizzato un piano cartesiano, detto piano di Clapeyron, che ha sull’asse x il volume del gas e sull’asse y la pressione di un gas.
Trasformazione isocora Trasformazione isobara Trasformazione isoterma Ciclo termodinamico
- Nella prima trasformazione si ha una riduzione di pressione a volume e temperatura costante;
- Nella seconda trasformazione si ha un aumento di volume a pressione e temperatura costante;
- Nella terza trasformazione si ha una riduzione di pressione e aumento di volume a temperatura costante (legge di Boyle);
- Nel quarto grafico è indicato un ciclo termodinamico completo.
Il lavoro
Immaginiamo di avere una pentola cilindrica con un coperchio che può scorrere all’interno di essa e perfettamente aderente, in modo da non far uscire il gas contenuto nella pentola. Se si abbassa il coperchio, il volume di gas si riduce e ne aumenta la pressione, se si solleva si riduce la pressione e aumenta il volume. Se scaldiamo il gas contenuto nella pentola, esso si espande facendo sollevare il coperchio: sta compiendo un lavoro.
Il lavoro che sta compiendo il gas sul coperchio si può calcolare facendo il prodotto della forza peso del coperchio per il suo spostamento (la differenza tra l’altezza finale del coperchio e l’altezza iniziale).
Volendo calcolare il lavoro:
ricordando che la la forza che una pressione esercita su una superficie è:
si ottiene:
dove p è costante (trasformazione isobara) e
cioè la variazione di volume dovuta all’espansione del gas, quindi:
Si può quindi affermare che:
Il principio zero della termodinamica
stabilisce che: “se un corpo A è in equilibrio termico con un corpo B , e il corpo B è a sua volta in equilibrio termico con un altro corpo C, allora A è senz’altro in equilibrio termico con il corpo C ”.
Primo principio della termodinamica
Come si vede dall’immagine sopra, per far espandere il gas abbiamo dovuto somministrare una certa quantità di calore Q e il gas sollevando il coperchio ha prodotto un lavoro L. Quindi il gas ha acquisito calore (+) e ceduto lavoro(-).
La somma algebrica tra il calore e il lavoro ci dice quanta energia “trattiene” il gas dopo la trasformazione.
Tale energia indicata con U è chiamata energia interna:
questa equazione rappresenta il primo principio della termodinamica e si può esprimere con la seguente definizione:
La variazione di energia interna di un gas è pari alla differenza tra il calore assorbito (o ceduto) dal gas e il lavoro compiuto (o acquisito) dal gas.
Convenzioni sui segni di Q e L
Esercizio guida
Un cilindro metallico chiuso da un pistone mobile è immerso in una grande vasca di acqua ghiacciata. Il gas all’interno del cilindro viene compresso lentamente da una forza pari a 955 N. Il pistone si abbassa di 10,0 cm.
- Di che trasformazione si tratta?
- Di quanto varia l’energia interna?
- Il sistema scambia calore con l’esterno?
- Quanto vale il calore scambiato? [0 J; −95,5 J]
Svolgimento
Iniziamo a calcolare il lavoro compiuto dal pistone sul gas:
Questo valore, osservando la figura della convenzione sui segni è negativo.
Osservando che il sistema cilindro pistone è immerso in una grande vasca a temperatura costante poiché contiene acqua ghiacciata (0°C), quindi la trasformazione è isoterma (primo quesito).
Ciò ci fa capire che non c’è variazione di energia interna del sistema poiché la sua temperatura si mantiene costante, quindi possiamo affermare che:
scrivendo il 1° principio della termodinamica e ricavando da esso Q:
N.B.: il lavoro ha segno negativo poiché è un lavoro che viene applicato dall’esterno sul gas (guarda la convezione sui segni di Q e L).
Il secondo principio della termodinamica
Formulazione di Kelvin-Planck
È impossibile realizzare una trasformazione ciclica il cui unico risultato sia la trasformazione in lavoro di tutto il calore assorbito da una sorgente omogenea.
Commentando l’immagine sopra, una macchina termica può produrre lavoro solo se assorbe calore dal sistema e cede calore al sistema. Per esempio il motore dell’automobile assorbe calore dalla combustione del carburante e cede all’ambiente calore attraverso il radiatore.
Centrale termonucleare
In quest’ultimo caso, il calore in uscita dalla centrale viene ceduto a fiumi, al mare o in assenza di essi nelle vicinanze alle torri di refrigerazione. Attualmente si sta sempre più cercando di “vendere” questo calore alle abitazioni circostanti come riscaldamento (acqua calda e/o riscaldamento). In questo caso si evita di innalzare la temperatura di fiumi e mare (inquinamento), evita che le case vicine usino la proprie caldaie per produrre acqua calda. Questa tecnica è chiamata cogenerazione, ossia generazione combinata di energia elettrica e calore.
Formulazione di Clausius
È impossibile realizzare una trasformazione il cui unico risultato sia quello di trasferire calore da un corpo più freddo a uno più caldo senza l’apporto di lavoro esterno.
In definitiva, questo principio ci dice che è impossibile realizzare una macchina termica il cui rendimento sia pari al 100%.
Per rendimento () di una macchina si intende il rapporto tra il lavoro prodotto (Q) e il calore necessario per produrlo:
essendo dato dalla divisione tra due grandezze che hanno la stessa unità di misura sarà un numero adimensionale inoltre il suo valore è compreso tra zero e uno:
Mappa concettuale delle leggi della termodinamica

(Fonte: https://www.docsity.com/it/)